| 恶病质 | |
|---|---|
| 其他名称 | 消瘦综合症 |
 |
|
| 与癌症相关恶病质相关的过程和机制 | |
| 专业 | 肿瘤学、内科、物理医学和康复 |
| 症状 | 突然体重减轻,饮食信号改变 |
| 预后 | 很穷 |
| 频率 | 1% |
| 死亡人数 | 每年 1.5 到 200 万人 |
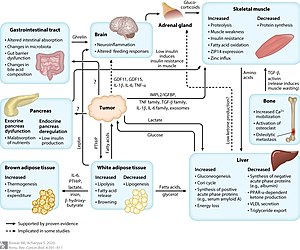
恶病质 是一种复杂的综合征,与导致持续肌肉损失的潜在疾病相关,营养补充不能完全逆转这种疾病。 一系列疾病可引起恶病质,最常见的是癌症、充血性心力衰竭、慢性阻塞性肺病、慢性肾病和艾滋病。 这些疾病引起的全身炎症会导致新陈代谢和身体成分的有害变化。 与热量摄入不足导致的体重减轻相比,恶病质主要导致肌肉减少而不是脂肪减少。 由于缺乏完善的诊断标准,恶病质的诊断可能很困难。 恶病质可以通过治疗基础疾病得到改善,但其他治疗方法的益处有限。 恶病质与死亡率增加和生活质量差有关。
是什么导致恶病质?
恶病质可由多种疾病引起,但最常与终末期癌症有关,称为 癌症恶病质. 大约 50% 的癌症患者患有恶病质。 患有上消化道癌和胰腺癌的人出现恶病质症状的频率最高。 恶病质的患病率在更晚期阶段上升,估计会影响 80% 的晚期癌症患者。
充血性心力衰竭、艾滋病、慢性阻塞性肺病和慢性肾病是经常引起恶病质的其他疾病。 恶病质也可能是晚期囊性纤维化、多发性硬化、运动神经元病、帕金森病、痴呆、肺结核、多系统萎缩、汞中毒、克罗恩病、类风湿性关节炎和乳糜泻以及其他全身性疾病的结果。
恶病质的机制
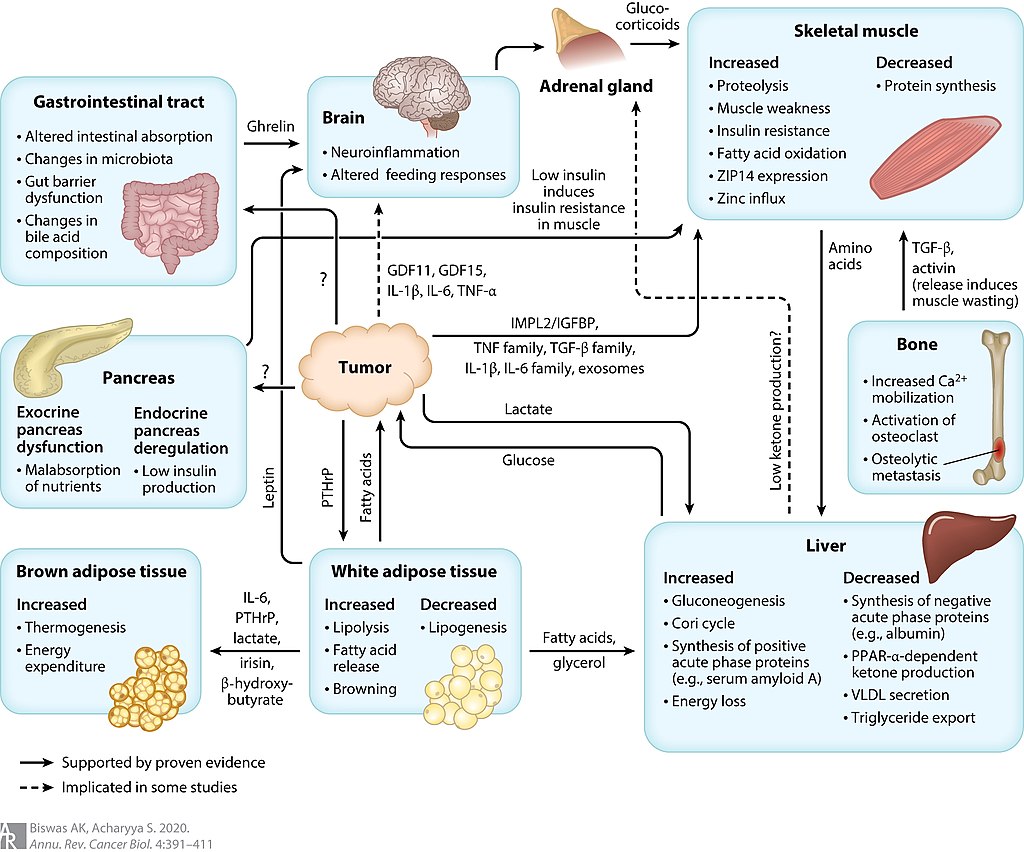
这些疾病引起恶病质的确切机制知之甚少,并且可能是多因素的,涉及多种疾病途径。 炎症细胞因子似乎发挥着核心作用,包括 TNF(也称为“恶病质素”或“恶病质素”)、干扰素 γ 和白细胞介素 6。 TNF 已被证明通过泛素蛋白酶体对骨骼肌和脂肪组织具有直接的分解代谢作用途径。 该机制涉及活性氧的形成,导致转录因子 NF-κB 的上调。 NF-κB 是编码细胞因子和细胞因子受体的基因的已知调节因子。 细胞因子产生的增加诱导肌原纤维蛋白的蛋白水解和分解。 全身性炎症还通过抑制 Akt/mTOR 通路导致蛋白质合成减少。
尽管许多不同的组织和细胞类型可能是导致循环细胞因子增加的原因,但有证据表明肿瘤本身是可能促进癌症恶病质的重要因素来源。 肿瘤衍生分子如脂质动员因子、蛋白水解诱导因子和线粒体解偶联蛋白可能会诱导蛋白质降解并导致恶病质。 恶病质中不受控制的炎症会导致静息代谢率升高,进一步增加对蛋白质和能源的需求。
也有证据表明恶病质中的喂养控制回路发生了改变。 高水平的瘦素(一种由脂肪细胞分泌的激素)会阻止神经肽 Y 的释放,神经肽 Y 是下丘脑食欲网络中最有效的摄食刺激肽,尽管对营养物质的代谢需求很高,但仍会导致能量摄入减少。
诊断 恶病质
尽管恶病质普遍存在且标准各不相同,但直到最近才提出诊断指南和标准,恶病质的主要特征包括肌肉和脂肪量的进行性消耗,食物摄入减少,碳水化合物、蛋白质和脂肪的代谢异常,生活质量下降,并增加身体损伤。
从历史上看,体重变化被用作恶病质的主要指标,包括低体重指数和超过 10% 的非自愿体重减轻。 仅使用体重受到水肿、肿瘤块和普通人群肥胖率高的限制。 基于体重的标准不考虑身体成分的变化,尤其是瘦体重的减少。
在尝试对恶病质负担进行更广泛的评估时,除了体重之外,还提出了使用实验室指标和症状评估的诊断标准。 标准包括在 12 个月内体重减轻至少 5% 或体重指数低(小于 22 kg/m2) 至少具有以下三个特征:肌肉力量下降、疲劳、厌食、无脂肪质量指数低或生化异常(炎症标志物升高、贫血、血清白蛋白低)。 在癌症患者中,恶病质被诊断为体重意外减轻超过 5%。 适用于体重指数低于 20 kg/m 的癌症患者2, 恶病质是在意外体重减轻超过 2% 后被诊断出来的。 此外,它可以通过肌肉减少症或骨骼肌质量损失来诊断。
实验室标志物用于评估恶病质患者,包括白蛋白、前白蛋白、C 反应蛋白或血红蛋白。 然而,实验室指标和临界值在不同的诊断标准中并没有标准化。 有时会测量急性期反应物(IL-6、IL-1b、肿瘤坏死因子-a、IL-8、干扰素-g),但与结果的相关性较差。 没有生物标志物可以识别可能发展为恶病质的癌症患者。
为了更好地对恶病质严重程度进行分类,已经提出了几种评分系统,包括恶病质分期评分 (CSS) 和恶病质评分 (CASCO)。 CSS 考虑了体重减轻、肌肉功能的主观报告、体能状态、食欲减退和实验室变化,将患者分为非恶病质、恶病质前期、恶病质和难治性恶病质。 恶病质评分 (CASCO) 是另一个经过验证的评分,包括对体重减轻和成分、炎症、代谢紊乱、免疫抑制、身体机能、厌食和生活质量的评估。
由于难以以非侵入性和成本效益的方式测量肌肉质量和健康,因此评估身体成分的变化受到限制。 已经研究了定量肌肉质量的成像,包括生物电阻抗分析、计算机断层扫描、双能 X 射线吸收测定法 (DEXA) 和磁共振成像,但并未广泛使用。
恶病质的定义
恶病质的识别、治疗和研究历来因缺乏广泛接受的恶病质定义而受到限制。 2011 年,一个国际共识小组将恶病质定义为“一种多因素综合征,其定义为骨骼肌量持续减少(伴有或不伴有脂肪量减少),可以通过常规营养支持部分但不能完全逆转”。
恶病质不同于由于吸收不良引起的营养不良、神经性厌食症或重度抑郁症引起的厌食症引起的体重减轻。 热量摄入不足导致的体重减轻通常会在肌肉减少之前导致脂肪减少,而恶病质主要导致肌肉萎缩。 恶病质也不同于肌肉减少症或与年龄有关的肌肉损失,尽管它们经常共存。
恶病质的治疗
恶病质的管理取决于根本原因、一般预后和受影响者的需要。 恶病质最有效的方法是治疗潜在的疾病过程。 一个例子是通过高效抗逆转录病毒疗法减少由 AIDS 引起的恶病质。 然而,这通常不可能或可能不足以逆转其他疾病中的恶病质综合征。 减轻肌肉损失的方法包括运动、营养疗法和药物治疗。
锻炼
由于运动对骨骼肌的积极影响,推荐使用包括定期体育锻炼的疗法来治疗恶病质。 恶病质患者通常报告体育活动水平低,很少进行日常锻炼,这是因为锻炼的动机低,并且认为锻炼可能会加重他们的症状或造成伤害。
药物
食欲刺激药物用于治疗恶病质以增加食物摄入,但不能有效阻止肌肉萎缩,并且可能具有有害的副作用。 食欲兴奋剂包括糖皮质激素、大麻素或孕激素如醋酸甲地孕酮。 5-HT等止吐药3 如果恶心是一个突出的症状,拮抗剂也常用于癌症恶病质。
氧雄龙等合成代谢雄激素类固醇可能对恶病质有益,但建议最多使用两周,因为较长的治疗时间会增加副作用。 虽然初步研究表明沙利度胺可能有用,但 Cochrane 评价发现没有证据表明该药物可用于治疗恶病质癌症患者做出明智的决定。
营养
恶病质中常见的代谢率增加和食欲抑制会加剧肌肉损失。 使用高热量蛋白质补充剂的研究表明,至少可以实现体重稳定,尽管在这些研究中没有观察到瘦体重的改善。
补充剂
已经研究了外源氨基酸的施用通过为肌肉代谢和糖异生提供底物来作为节省蛋白质的代谢燃料。 支链氨基酸亮氨酸和缬氨酸可能具有抑制蛋白质分解途径过表达的潜力。 氨基酸谷氨酰胺已被用作口服补充剂的成分,以逆转晚期癌症或 HIV/AIDS 患者的恶病质。
β-羟基 β-甲基丁酸 (HMB) 是亮氨酸的代谢物,可作为信号分子刺激蛋白质合成。 研究表明,慢性肺病、髋部骨折以及艾滋病相关和癌症相关恶病质的阳性结果。 然而,许多这些临床研究使用 HMB 作为与谷氨酰胺、精氨酸、亮氨酸、更高膳食蛋白质和/或维生素联合治疗的一个组成部分,这限制了对单独 HMB 功效的评估。
流行病学
由于诊断标准的变化和对恶病质患者的识别不足,缺乏关于恶病质流行率的准确流行病学数据。 据估计,来自任何疾病的恶病质估计会影响美国超过 500 万人。 恶病质的患病率正在增长,估计约占人口的 1%。 亚洲的患病率较低,但由于人口较多,造成了类似的负担。 恶病质也是南美洲和非洲的一个重大问题。
在美国,按人口患病率计算,恶病质最常见的原因是:1) COPD,2) 心力衰竭,3) 癌症恶病质,4) 慢性肾病。 恶病质在癌症患者中的患病率从 15% 到 60% 不等,在晚期癌症患者中估计增加到 80%。 这种广泛的范围归因于恶病质定义、癌症人群的变异性和诊断时间的差异。 尽管 COPD 或心力衰竭患者的恶病质患病率较低(估计为 5% 至 20%),但大量患有这些疾病的人会显着增加恶病质的总负担。
恶病质导致功能和医疗保健利用的显着丧失。 使用美国国家住院患者样本的估计表明,2016 年恶病质占 177,640 次住院。恶病质被认为是许多癌症患者死亡的直接原因,估计在 22-40% 之间。




Discussion about this post